Determinación de la constante de Henry de la disolución del CO2 en un refresco dietético
Contenido principal del artículo
Resumen
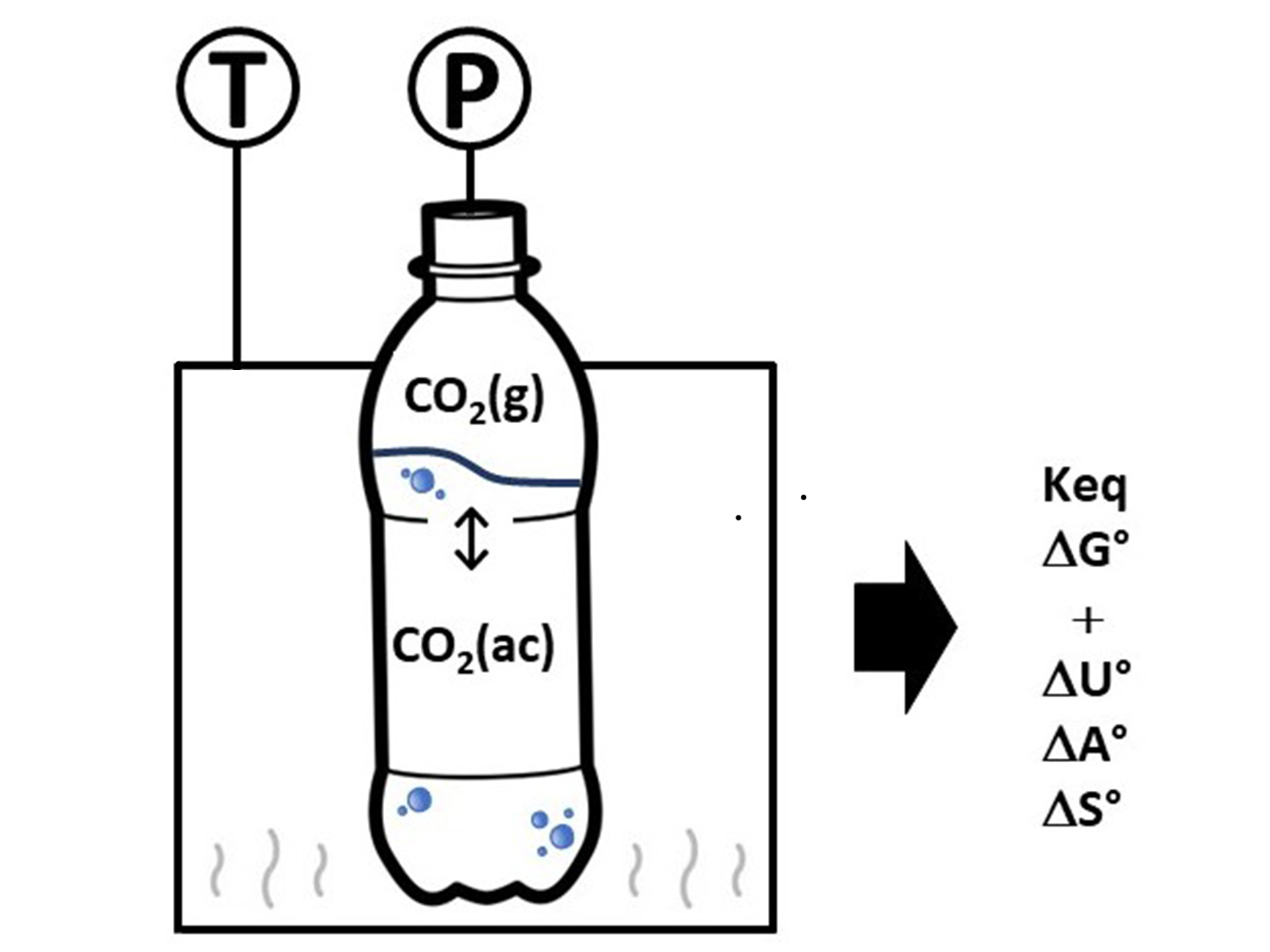
Se propone un experimento, empleando como sistema un refresco de cola dietético comercial, con el fin de determinar la constante de Henry del equilibrio químico de distribución del dióxido de carbono (CO2) entre las fases gaseosa y acuosa a diferentes temperaturas, de acuerdo con la ecuación química: CO2 (ac) ⇌ CO2 (g).
Para este proceso químico se calcularon las siguientes propiedades termodinámicas: ΔH0, ΔS0, ΔG0, ΔU0 y ΔA0 a 298.15 K, y la constante de Henry. Utilizando las propiedades calculadas, se propone explicar la relación matemática entre ellas y su aplicación en la descripción del equilibrio químico del CO2 entre las fases acuosa y gaseosa del sistema. Asimismo, se utilizó la constante de equilibrio para explicar la variación de la solubilidad del CO2 como función de la temperatura y la presión. Finalmente, se contextualizó la solubilidad del CO2 en la fase acuosa con las propiedades organolépticas de la bebida y el mantenimiento de la forma del recipiente.
Detalles del artículo
Citas en Dimensions Service
Citas
Atkins, P., De Paula, J. (2010). Physical Chemistry. 9th Ed. H. Freeman and Company. pp. 172, 213, 220.
Baur, J. E.; Baur, M. B.; Franz, D. A. (2006). The Ultrasonic Soda Fountain: A Dramatic Demonstration. J. Chem. Educ. 83, 577-580. https://doi.org/10.1021/ed083p577
Berrio, A. T. (2009). La experimentación dirigida como método eficaz de la investigación y del aprendizaje significativo. [Proyecto aplicado, Universidad Nacional Abierta y a Distancia UNAD]. Repositorio Institucional UNAD.
Chang, R. (2000). Fisicoquímica para las ciencias químicas y biológicas. 3° ed., (R. Zugazagoitia Herranz, Trad.). McGraw Hill. pp. 86-88, 165-171, 215-217, 232-235, 301-315.
Huber C. J. and Massari A. M. (2014). Quantifying the Soda Geyser. J. Chem. Educ. 91 (3), 428-431. https://doi.org/10.1021/ed300694n
Kuntzleman, T. and Sturgis, A. (2020). Effect of temperature in experiments involving carbonated beverages. J. Chem. Educ. 97 (11), 4033-4038. https://dx.doi.org/10.1021/acs.jchemed.0c00844
La química del agua carbonatada. (5 de agosto de 2021) La química del agua carbonatada. QuímicaFacil.net, en la URL https://quimicafacil.net/notas-de-quimica/la-quimica-del-agua-carbonatada/
León Cedeño, F., Jiménez Curiel, C. D. C. (2022). Experiencias docentes durante la pandemia. Curso experimental. Educación Química, 33(2), 82-93.
Levy J. B.; Hornack F. M.; Levy M. A. (1987). Simple Determination of Henry’s Law Constant for Carbon Dioxide. J. Chem. Educ. 64(3), 260-261. https://dx.doi.org/10.1021/ed064p260
Li D.; Duan Z. (2007). The specification equilibrium coupling with phase equilibrium in the H2O-CO2-NaCl system from 0 to 250°C, from 0 to 1000 bar, and from 0 to 5 molality of NaCl. Chem. Geol. 244, 730-751. https://doi.org/10.1016/j.chemgeo.2007.07.023
Miller, J. N.; Miller, J. C. (2005). Statistics and Chemometrics for Analytical Chemistry. (pp.107-111). Pearson.
Nyasulu F.; Barlag R.; McMills L.; Arthasery P. (2019). Mass-based Approach to the Determination of the Henry’s Law Constant for CO2 (g) Using a Diet Carbonated Beverage. J. Chem. Educ. 96(11), 2661-2664. https://dx.doi.org/10.1021/acs.jchemed.9b00082

Educación Química por Universidad Nacional Autónoma de México se distribuye bajo una Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional.
Basada en una obra en http://www.revistas.unam.mx/index.php/req.